肺癌是全球导致癌症相关死亡的首要原因之一,其中非小细胞肺癌约占肺癌的 80%,因此迫切需要一种创伤性低、临床疗效高和副作用小的替代方式来改善NSCLC 患者的预后。目前,光动力疗法 (Photodynamic therapy, PDT)与免疫疗法相结合作为目前最有前景的治疗方法之一,然而,由于精确的药物递送技术的缺乏以及肿瘤微环境 (TME)和免疫抑制的复杂特性,导致疗效不够理想。
近日,我院蒋宁/彭奇龄/王建为/魏余贤团队在生物材料1区杂志Bioactive Materials (最新 IF: 18.9)上发表题为“Reprogramming exosomes for immunity-remodeled photodynamic therapy against non-small cell lung cancer”的研究论文,报道一种重编程的外泌体,将光动力与免疫治疗相结合并通过克服肿瘤内缺氧和重塑肿瘤免疫微环境,实现对非小细胞肺癌的精准药物递送和协同治疗,运载多种干预措施实施多层次治疗策略,从而达到对非小细胞肺癌更好的疗效。

PDT 近几年来已成为一种新兴的浅表性肿瘤的治疗方法,具有微创、高选择性、低毒性和可重复使用等优点。吲哚菁绿 (ICG) 是 FDA 批准的体内诊断试剂,可作为光敏剂用于 PDT。二氧化锰 (MnO2) 作为一种独特的新型治疗药物,将TME 中存在的 H2O2催化分解为水和 O2从而缓解肿瘤内部缺氧,具有较高的生物安全性。综上,利用 MnO2 负载足量的 ICG,能够极大地增加载药能力并延长光敏剂在生物体内的半衰期,最终显著提高 PDT 的治疗效果。
免疫治疗主要是利用免疫检查点抑制剂 (Immune checkpoint inhibitors,ICIs) 来抑制免疫检查点功能并重新激活机体的免疫功能的一类药物。最典型的是,肿瘤细胞表面的 PD-L1 与 T 细胞表面的 PD-1 结合可抑制 T 细胞活性,使肿瘤细胞逃逸 T 淋巴细胞的攻击,而 PD-L1 抗体可以阻断 PD-1/PD-L1 信号通路,恢复 T 细胞对肿瘤细胞的识别和杀伤作用。
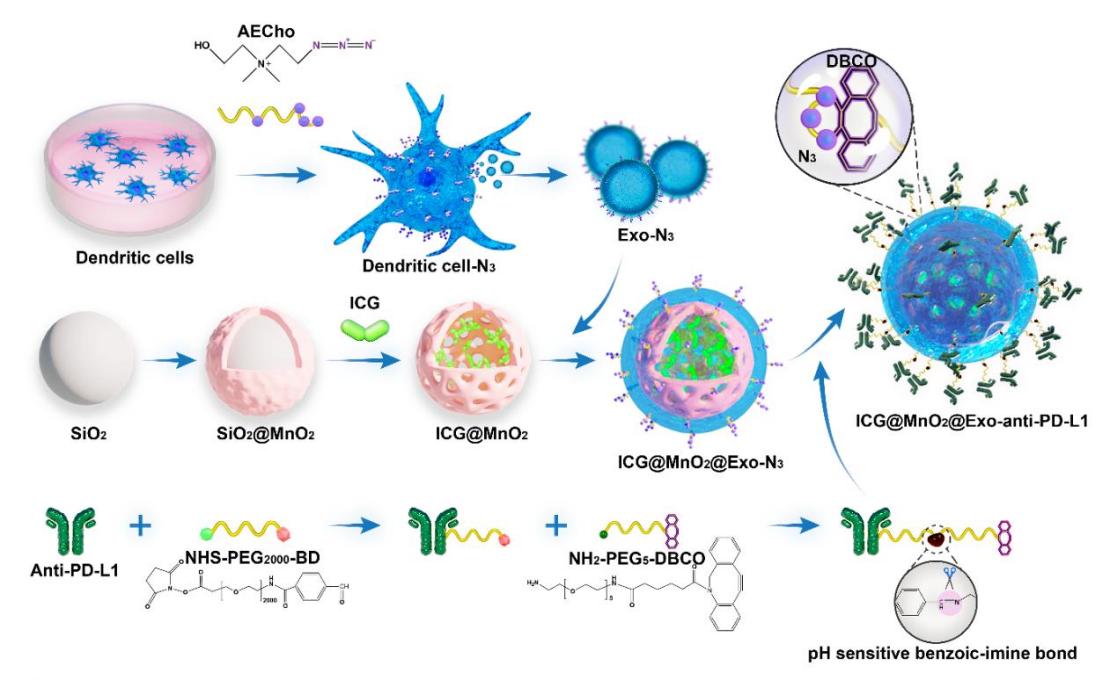
在此项研究中,研究人员将 PDT 与免疫治疗相结合,构建了装载 ICG 的中空 MnO2 NPs, 将 其 封 装 在 经 过 叠 氮 胆 碱 (AECho) 处 理 的 DCs 衍 生 外 泌 体 中。随后,使用被 DBCO 修饰的 PD-L1 单克隆抗体 (anti-PD-L1) 以点击化学反应的方法对外泌体进行重编程,该纳米系统可通过 PDT 和免疫治疗的协同作用有效调节 TME。该研究为治疗NSCLC提供了一种有前景的治疗策略,并显示出安全有效的临床应用潜力。
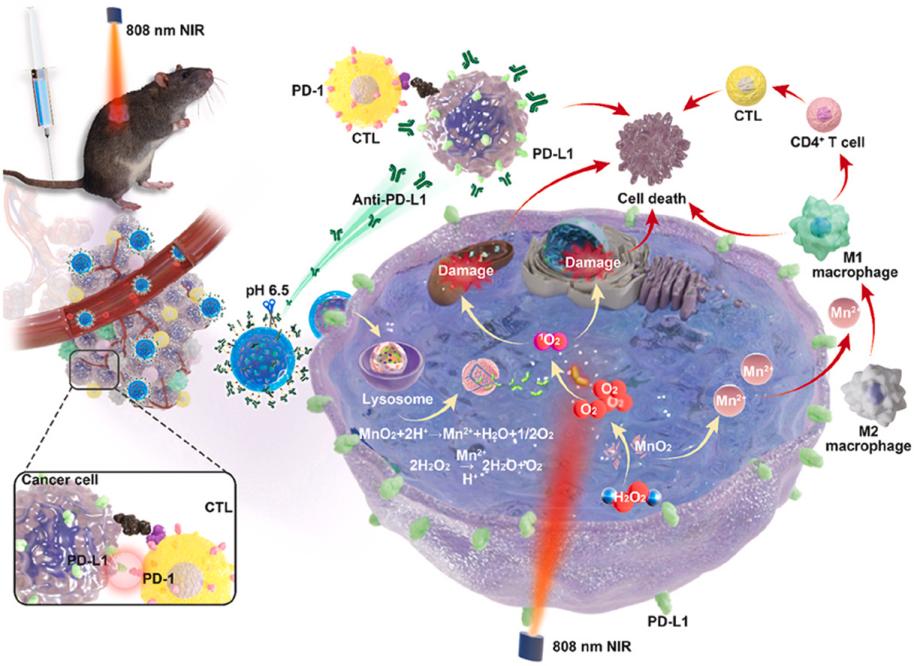
如图所示,该纳米系统通过尾静脉注射到 NSCLC模型小鼠体内后,可特异性靶向 PD-L1 过表达的肿瘤细胞,精确递送药物至肿瘤部位,并在酸性 TME 中释放抗 PD-L1 来解除肿瘤细胞对 T 淋巴细胞的免疫抑制作用。MnO2 NPs 被癌细胞内吞后可催化 H2O2 转化为 O2,缓解肿瘤缺氧。同时,ICG在近红外 (NIR) 照射下产生单线态氧 (1O2),从而破坏肿瘤细胞。此外,高水平的 H2O2将 MnO2 还原为 Mn2+,诱导肿瘤相关巨噬细胞从 M2 极化为 M1,进一步刺激 T 细胞活化并 重塑肿瘤免疫微环境,增强抗肿瘤免疫。
该论文通讯作者是重庆医科大学基础医学院蒋宁副教授、彭奇龄副教授及王建为副教授,重庆医科大学附属第一医院魏余贤副主任医师。重庆医科大学基础医学院硕士研究生郭焦、赵薇为该论文的共同第一作者。上述研究工作得到了国家自然科学基金、重庆市自然科学基金、重庆市教委基金以及重庆医科大学未来医学青年创新团队项目资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X24001968