近日,重庆医科大学基础医学院侯宇教授,陈哲副研究员联合重庆医科大学附属第二医院血液内科曾瀚庆教授团队,在Oncogene杂志在线发表了题为Targeting KPNB1 suppresses AML cells by inhibiting HMGB2 nuclear import的研究论文,该研究发现核转运蛋白KPNB1是干预AML的新靶点,阐明了KPNB1通过转运HMGB2蛋白入核促进AML细胞DNA损伤后修复的作用机制,并发现KPNB1抑制剂IPZ与Bcl-2抑制剂venetoclax联合使用具有协同抑制AML的效果。

急性髓系白血病(Acute myeloid leukemia, AML)是一类以原始/幼稚髓系细胞异常增生为特征的血液系统恶性肿瘤,具有发病率高、病情急重、易复发等特点,患者5年生存率低于40%。因此,发现干预AML的特异性靶点、阐明其作用机制、探寻候选药物,对AML的临床干预具有重要理论及应用价值。
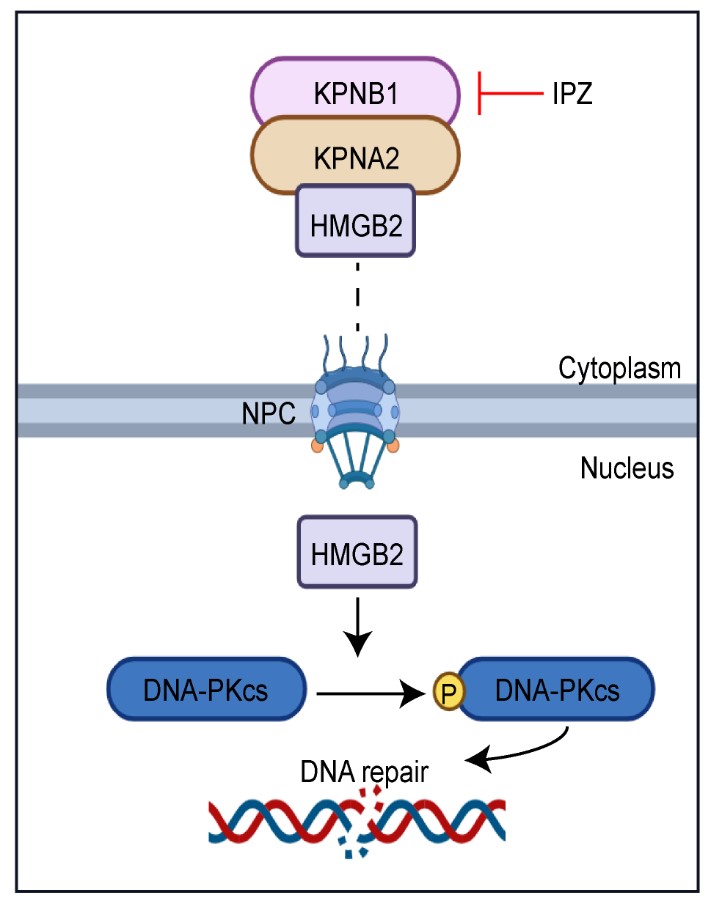
本研究中,研究人员通过分析AML患者测序数据发现,核转运蛋白KPNB1在多种亚型的AML患者中显著高表达,其高表达与患者不良预后显著相关。敲低或KPNB1抑制剂IPZ干预都会导致AML细胞系及患者细胞的增殖能力下降,凋亡显著升高。MLL-AF9诱导的AML小鼠在给予IPZ注射后,体内AML细胞比例显著降低,浸润减少,凋亡增加且生存期延长。此外,IPZ对正常造血功能影响轻微,显示出良好的治疗窗口。研究人员利用定量蛋白质谱及免疫共沉淀发现了KPNB1的货物蛋白HMGB2。已报道HMGB2能够识别并结合多种结构损伤的DNA区域,并促进DNA-PKcs磷酸化,促进DNA损伤修复。Co-IP及邻位连接技术(PLA)进一步证实KPNB1通过接头蛋白KPNA2结合HMGB2并转运其入核。抑制KPNB1会阻碍HMGB2的核转位,造成AML细胞的DNA损伤修复受阻,从而导致细胞凋亡。研究人员构建了不依赖KPNB1入核的HMGB2突变体,回复HMGB2的核定位,发现有效阻碍IPZ诱导的AML凋亡。此外研究人员通过体外实验及PDX模型证实IPZ及Bcl-2抑制剂venetoclax在抗AML中具有协同效应,IPZ处理增加了AML细胞对venetoclax的敏感性。总之,这些发现阐明了核转运蛋白KPNB1在AML中的作用机制,更为干预AML提供了新思路。
重庆医科大学基础医学院侯宇教授、陈哲副研究员,以及重庆医科大学附属第二医院血液内科曾瀚庆教授为该论文的共同通讯作者,基础医学院硕士研究生谢雨欣为该论文的第一作者。本课题受重庆市杰出青年科学基金、CQMU未来医学青年创新计划、重庆市教委科技研究计划和重庆市博士后科学基金等项目的资助。
全文链接:https://www.nature.com/articles/s41388-025-03340-0